中国科学院广州生物医药与健康研究院研究员孔祥谦团队与山东大学药学院副教授侯旭奔团队合作,开发出抗实体肿瘤的DNA甲基转移酶1(人生就是博尊龙DNMT1)和组蛋白去乙酰化酶(HDACs)的双效抑制剂。相关成果近日发表于《美国药物化学杂志》(Journal of Medicinal Chemistry)。
DNMT1/HDAC双效抑制剂(R)-23a设计策略及活性数据。研究团队供图
?
表观遗传修饰异常是恶性肿瘤发生、发展的关键驱动力。其中,启动子区DNA过度甲基化和组蛋白乙酰化缺失在癌症中广泛存在,是导致肿瘤转录失调和异常谱系分化的重要因素。目前,已有多种DNMTs和HDACs抑制剂获批用于血液系统肿瘤治疗。然而,这些药物的代谢稳定性差,治疗窗口窄,实体瘤治疗效果不足,临床治疗亟需发现新型表观遗传药物或探索联用方案。
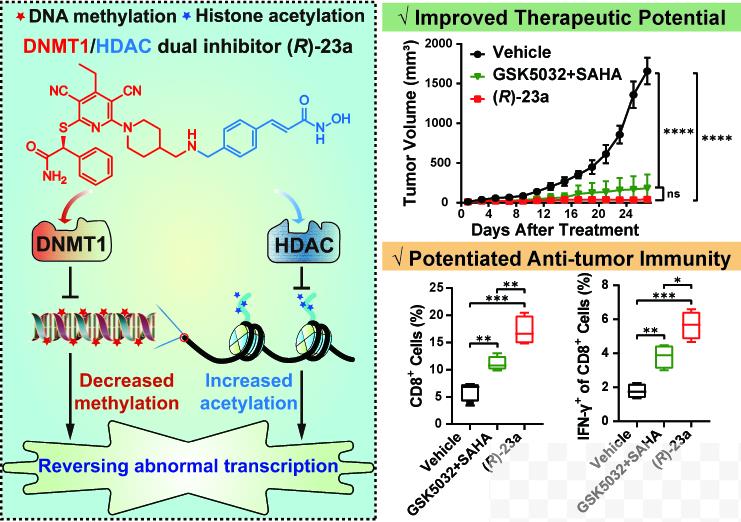
该研究中,研究人员在国家自然科学基金、山东省泰山学者项目、中国科学院和珠江人才计划等项目的支持下,通过融合DNMT1和HDAC抑制剂的关键药效基团,获得了一系列DNMT1/HDAC双效抑制剂。其中,化合物(R)-23a在体外和细胞中对DNMT1和Class-I HDAC表现出有效的“在靶”抑制活性,从而逆转肿瘤特异性DNA高甲基化和组蛋白低乙酰化。与DNMT1或HDAC单靶点抑制剂相比,化合物(R)-23a引起更为显著的转录组变化,包括激活多个表观遗传沉默的抑癌基因和下调关键致癌基因。
在抗肿瘤活性和安全性方面,DNMT1/HDAC双效抑制剂(R)-23a可通过直接杀伤肿瘤细胞,或重编程肿瘤免疫微环境,进而诱导实体肿瘤的消退,其抗肿瘤活性和安全性优于单一靶点药物联用。
该研究提供一种新型DNMT1/HDAC双效抑制剂,能够有效逆转表观遗传修饰异常,进而发挥抗实体瘤活性,为新型抗肿瘤药物的研发和基于异常谱系重塑的肿瘤治疗新策略提供药物先导化合物。
相关论文信息:https://doi.org/10.1021/acs.jmedchem.4c01310
